Vocabulario
Amorfo: se dice del cuerpo sólido carente de estructura cristalina, en el que las partículas se ordenan de forma irregular.
Cristalino: se dice del cuerpo cuyas partículas componentes se sitúan de acuerdo a una estructura geométrica.
Cristal: forma externa ideal de un sólido cristalino.
Sólido cristalino: cuerpo en estado sólido que se caracteriza por disponer sus componentes en una forma ordenada geométricamente. A diferencia de «cristal», la expresión «sólido cristalino» se refiere más bien a la apariencia interna del cuerpo.
|
Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
|
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente. En la siguiente simulación interactiva están representados 2 átomos de cloro con solo sus capas externas de electrones. Aproxima un átomo a otro con el ratón y observa lo que ocurre:
En otros casos un mismo átomo puede compartir más de un par de electrones con otros átomos. Por ejemplo en la molécula de agua (H2O) el átomo de oxígeno central comparte un par de electrones con cada uno de los dos átomos de hidrógeno. Estos pares de electrones compartidos se representan habitualmente por una barra entre los dos átomos unidos
|
Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio. En la siguiente simulación interactiva están representados los átomos de sodio y cloro con solo sus capas externas de electrones. Aproxima un átomo a otro con el ratón y observa lo que ocurre:
|
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces químicos.
¿Por qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomo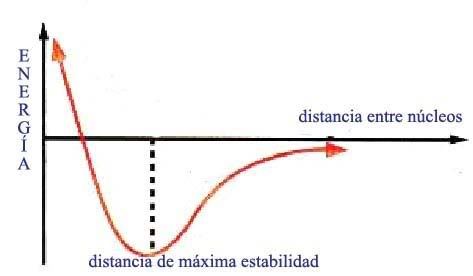 s en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles. Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad.
s en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles. Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad.
Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los átomos de los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
Distintos tipos de enlaces
Las propiedades de las sustancias dependen en gran medida de la naturaleza de los enlaces que unen sus átomos.
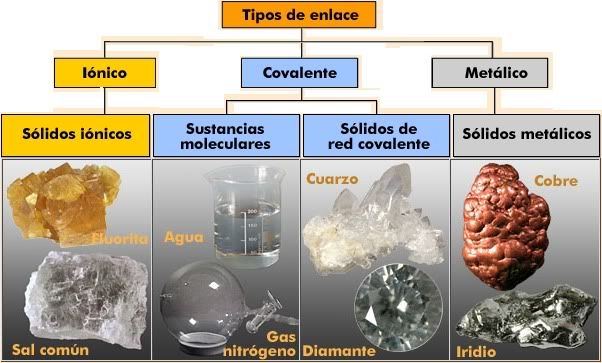
Existen tres tipos principales de enlaces químicos: enlace iónico, enlace covalente y enlace metálico. Estos enlaces, al condicionar las propiedades de las sustancias que los presentan, permiten clasificarlas en: iónicas, covalentes y metálicas o metales.


|
(Del gr. crustalloz y -grafía) Ciencia que estudia los cristales y la forma que adoptan los cuerpos al cristalizar: la cristalografía está regida por leyes físico-químicas. Ciencia que se centra en el estudio de las sustancias cristalinas (cristales), de manera que describe su morfología externa, organización interna y sus propiedades físicas y químicas. Aunque la cristalografía comienza su desarrollo como una rama de la mineralogía, hoy en día se la considera como una ciencia en sí misma, que trata de la materia cristalina, ya sea de origen natural (minerales), o artificial. Por cristal se entiende toda sustancia sólida inorgánica de origen natural, composición química homogénea y con una estructura interna constituida por elementos que se repiten ordenadamente en el espacio y presentan ciertas relaciones de simetría.
Las partículas de los cuerpos sólidos, salvo excepciones, se ordenan en el espacio de acuerdo a determinados tipos de redes geométricas, también llamadas cristalinas. Esta ordenación, le da a los sólidos su consistencia y la mayor parte de sus propiedades.
Generalidades
Los sólidos cristalinos tienden a adoptar estructuras internas geométricas basadas en líneas rectas y planos paralelos. Ahora bien, el aspecto externo de un cristal no es siempre completamente regular, pues depende de una serie de condiciones:
- Composición química: el sólido puede ser una sustancia simple o un compuesto, y puede contener impurezas que alteren la estructura cristalina y otras propiedades, como la consistencia o el color.
- Temperatura y presión: ambas variables influyen en la formación de los cristales y su crecimiento. Por lo general, los cristales se forman en condiciones de alta presión y elevadas temperaturas.
- Espacio y tiempo: el crecimiento de un cristal puede verse limitado por ambos, especialmente por el primero, ya que a menudo la falta de espacio es responsable del aspecto imperfecto que ofrecen algunos cristales en su apariencia externa.
La simetría
Los cuerpos cristalinos forman redes que se ordenan en torno a una serie de elementos de simetría, cuya cantidad y distribución determina los diferentes sistemas de cristalización:
- Ejes de simetría: son líneas imaginarias que cruzan el interior de la estructura cristalina. Al girar 360º hacen que el motivo geométrico del cristal se repita un número determinado de veces. Los ejes de simetría pueden ser binarios, ternarios, cuaternarios y senarios, según el número de repeticiones que generen.
- Planos de simetría: son superficies planas que dividen el cristal en dos mitades exactamente iguales.
- Centros de simetría: son puntos imaginarios situados en el interior del cristal. Por ellos pasan los principales ejes y planos de simetría.

Distribución de los ejes y planos de simetría en el sistema cúbico.
Las redes cristalinas
Los componentes elementales de un cuerpo sólido pueden ser de cuatro tipos:
- Átomos: partículas elementales de materia con carga eléctrica neutra.
- Iones: átomos con carga eléctrica negativa (aniones) o positiva (cationes) debido a la transferencia o recepción, respectivamente, de uno o más electrones.
- Grupos iónicos: agrupación de varios iones del mismo o diferentes elementos químicos.
- Moléculas: agrupación de varios átomos del mismo o de diferentes elementos.
La ordenación geométrica de estos componentes en las tres direcciones del espacio da lugar a la formación de una red cristalina, una trama geométrica basada en la repetición de un cuerpo tridimensional determinado.
Existen catorce tipos de redes cristalinas, también llamadas redes de Bravais, que a su vez se agrupan en siete sistemas cristalinos:
- Triclínico.
- Monoclínico: simple y de bases centradas. Presenta un eje binario.
- Rómbico: simple, centrado, de bases centradas, y de caras y bases centradas. Posee tres ejes binarios.
- Romboédrico: posee un eje ternario.
- Hexagonal: presenta un eje cuaternario.
- Tetragonal: simple y centrado. Tiene un eje cuaternario.
- Cúbico: simple, centrado y de caras centradas. Presenta cuatro ejes ternarios.
Las redes de Bravais
A partir de los siete sistemas cristalinos se han podido describir catorce redes cristalinas, que son llamadas también redes de Bravais, en honor al mineralogista francés del siglo XIX Auguste Bravais, que fue el primero en proponer la hipótesis de la estructura reticular de los minerales.

Las catorce redes cristalinas de Bravais.
|
Los Solidos Cristalinos Son la
Segunda Gran Divicion de los Solidos:
En el estado Sólido las moléculas, iones o átomos están unidos por fuerzas relativamente intensas, formando un todo compacto.
La mayor proximidad entre sus partículas, es una característica de los sólidos, y permite que entren en uego las fuerzas de enlace, las cuales ordenan el conjunto dondo lugar a una red cristalina. Las partículas ocupan posiciones definidas y sus movimientos se limitan a vibraciones en torno al vértice de la red cristalina, por esta razón los sólidos poseen forma y volumen definido.
 Los sólidos en la naturaleza, la mayoría son cristalinos, pero dicha estructura ordenada no se refleja en forma geométrica regular que se vea a simple vista.Debido a que por lo general, están formados por pequeños cristales orientados de diferentes maneras, es decir, en una estructura POLICRISTALINA.
Los sólidos en la naturaleza, la mayoría son cristalinos, pero dicha estructura ordenada no se refleja en forma geométrica regular que se vea a simple vista.Debido a que por lo general, están formados por pequeños cristales orientados de diferentes maneras, es decir, en una estructura POLICRISTALINA.
En la red cristalina sus componetes elementales pueden ser átomos, iones o moléculas, por eso no se puede hablar de la molécula de un cristal, sino más bien de un retículo elemental o celdilla unidad la que se repite una y otra vez en una estructura períodica o red cristalina.
Las propiedades físicas de los sólidos ( tiempo de fusión,capacidad para conducir corriente, resistencia a la deformación ,dureza, entre otras.) dependen de las fuerzas de enlace entre sus partículas, ejemplos de estas son los sólidos: iónicos,formados por moléculas apolares y/o polares, metálicos y covalentes.
- Son duros y a la vez frágiles .
-Poseen altos puntos de fusión.
-Son malos conductores de eléctricidad.
-Sus disoluciones presentan a su vez una conductividad elevada.
- Sólidos formados por moléculas apolares:- Cl2,H2 y CO2
-Son blandos gracias a la debilidad en sus fuerzas de atracción, "Vander Waals". -Su punto de fusión es bajo, por lo que sólo a bajas
temperaturas, las fuerzas ordenadoras del enlace
predominan sobre el efecto disgregador del calor.
- Poseen conductivilidad eléctrica pero ésta es
extremadamente baja, por ausencia de cargas libres.
-H2O
- Posee características intermedias entre los sólido iónicos y los formados por moléculas apolares.
-Se caracteriza por su enlace metálico con gas de electrones
externos compartidos, debido a esto podemos decir :
-Son buenos conductores eléctricos y de calor. -Son ductiles.
-Son ductiles.
-Son maleables.
-Poseen puntos de fuisión alta.
-Están formados por una red tridimensional de enlaces atómicos fuertes, dando lugar a propiedades como:
-Poseen elevados puntos de fusión.
-Tienen escasa conductividad.
-Poseen extraordinariadureza.
Ejemplos de sólidos cristalinos:
En los ejemplos podemos encontar una gran cantidad de polímeros naturales.Estas partículas pueden ser átomos unidos por enlaces covalentes (diamante y metales) o iones unidos por electrovalencia (cloruro de sodio). Algunos ejemplos son:
- Diamante
- Cuarzo. Rubí.
- Cloruro de sodio. Sulfato de cobre.

- Azùcar
|














